 15
15
赛学企管成立于2008年,长期从事产品ISO9001质量管理体系、GB/T50430建筑企业质量管理体系、ISO14001环境管理体系、ISO45001职业健康安全管理体系、IATF16949汽车行业质量管理体系、ISO27001信息安全管理体系、ISO20000IT服务管理体系、ISO22000/HACCP食品安全管理体系、ISO13485器械质量管理体系、商品售后服务管理体系、GBT31950诚信管理体系认证、SA8000社会责任、住宿服务管理体系、教育服务管理体系、食品和饮料服务管理体系、ISO22301业务连续性认证、QC080000有害物质过程管理体系、FSC/COC森林认证和企业管理咨询服务。
我们始终以提升企业的管理水平、改善企业生命力、提高企业市场核心竞争力为大责任。现在以精益生产、产品模块化等制造理念,提供智能制造设计服务。为制造业提供:体系认证、智能制造工厂设计、柔性生产线信息系统、柔性设备控制系统、自动化立体仓库、AGV及物流自动化设备、视觉检测、工业机器人软件控制系统、数据采集分析、指挥、信息物理系统于一体的整体解决方案。
公司立足上海,服务全国,客户成功案例2000多,广受客户**;
公司的经营理念是“共生共赢,诚信立业,厚德载物,共谋宏图”,在行业中赢得了良好的客碑,以“专注、创优、服务创新、顾客满意”为高宗旨,为客户提供率、益的增值服务。
泉州ISO13485认证,纠正措施和预防措施的区别
一、定义不同:
纠正: 为消除已发现的不合格所采取的措施。
纠正措施:消除已发现的不合格或其他不期望情况的原因所采取的措施;
预防措施:为消除潜在的不合格或其他潜在不期望情况的原因所采取的措施。
二、目的不同:
纠正:针对不合格的处置。例如,在审核的报告/时发现填写有误,当即将错误之处改正过来,避免错误报告/流入顾客手中。
纠正措施:消除已发现的不合格的系统原因防止不合格再度发生;例如,通过建立模板来固定报告/上的检测/校准项目,防止今后不再出现项目遗漏的错误。
预防措施:揭示潜在的可能导致发生不合格的原因,防止发生不合格。例如,在阴霾天,许多人出门时戴上口罩。又如,作业现场的张贴的安全警示标识、质量提醒。
三、对象不同:
纠正:已发生;不合格,只是“就事论事”。
纠正措施:已发生;产生不合格或其他不期望情况的原因,是“追本溯源”。
预防措施:已潜在但未发生。潜在的不合格或其他潜在不期望情况的原因,是“未雨绸缪”、“防微杜渐”。
四、时效性不同
纠正:纠正是“返修”、“返工”、“降级”或“调整”,是对现有的不合格所进行的当机立断的补救措施,当即发生作用。
纠正措施:在已发生不合格的被动情况下的积极反应(事后防范);是针对不合格原因采取措施如通过修订程序和改进体系等,从根本上消除问题根源,通过跟踪验证才能看到效果。
预防措施:主动确定改进机会的过程(事前防范)。预防措施是针对潜在的不合格或其他潜在不期望情况的原因采取措施,措施的效果一般需要较长时期才能够看到效果。
五、效果不同:
纠正:是对不合格的处置,不涉及不合格工作的产生原因,不合格可能再发生,即纠正仅仅是“治标”。
纠正措施:纠正措施可能导致文件、体系等方面的更改,切实有效地纠正措施由于从根本上消除了问题产生的根源,可以防止同类事件的再次发生,因此就纠正措施是“标本兼治”。
预防措施:预防措施能彻底避免不合格或不期望情况发生。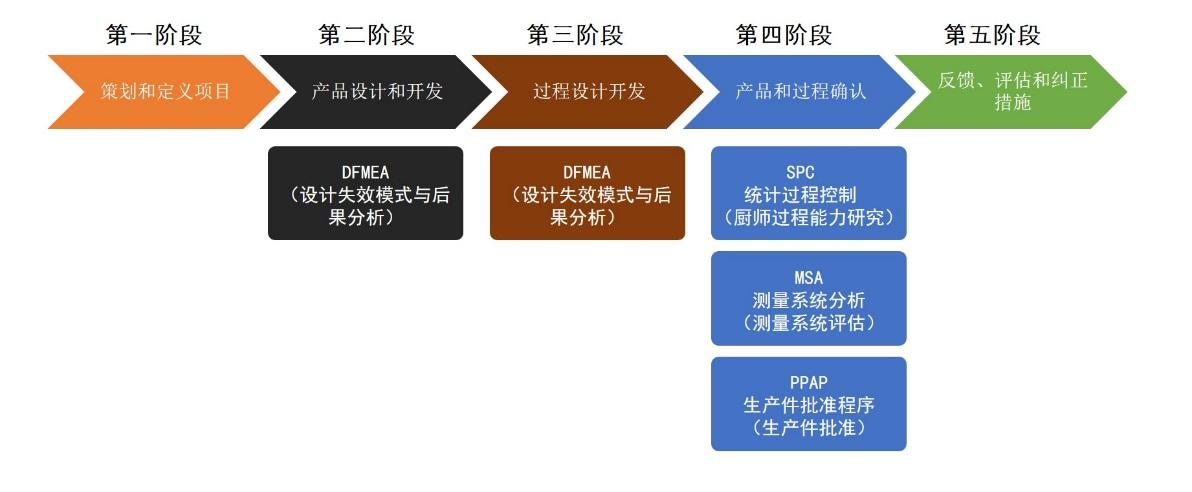
苏州ISO13485认证“确认”和“验证”的区别
ISO13485认证设计和开发验证
1、设计和开发验证的方法
设计开发输出的是信息(文件),为了确保设计和开发输出资料满足输入资料要求,根据设计和开发策划时做出的安排,对设计和开发进行验证。通常的验证方法是通过制造样机的方式来进行。验证的方法应根据具体情况选择以下方式(A,B两种方式选一种)
A. 当整个设计已完成时,可根据审通过的设计开发初稿制作样机。技术部负责对样机进行试验或外送到检测机构进行检测并出具检测报告作为验证依据。
B. 在设计开发适当阶段,对样机的部分设计或样机的功能、性能可采用与已证实成功的类似设计进行比较,用类似设计的相关证据,作为本阶段设计的验证依据。
此外,下列方法可以选用一种或多种验证,通过这些方法验证,以寻找设计输出可能存在的问题和缺陷,便于早一点修正。
2、ISO13485认证设计和开发验证的步骤
1)设计开发项目负责人综合所有的验证结果,编制《设计开发验证报告》,将验证结果和跟踪情况记录在报告内,报总批准。确保设计开发输入中每一项性能、功能指标都有相应的验证记录。
2)样机验证通过后,技术部组织相关部门对小批生产的可行性进行审,根据开发产品的特点,填写《试产报告》报总审核、董事长批准、然后确定开模、工装设计制造的投入、技术部协助生产部门进行小批试产(试产数量小于 50 台)。
3)品质部对小批试产的产品进行检验或试验,出具检测报告;技术部对生产工艺进行验证并出具工艺验证报告;供应部出具物料批量供应的可行性报告;财务部出具成本核 算报告;技术部综合上述资料填写《试产总结报告》,报总审核、董事长批准, 作为批量生产的依据。
三、ISO13485认证设计和开发确认
对开发新产品进行确认的目的是产品能够满足规定的和已知预期用途的要求。单件产品通常应在产品交付顾客之前确认,批量产品应在正式批量生产之前确认。如果开发新产品需要经过顾客使用一段时间以后才能完成确认工作的,应在可能的范围内,采用模拟方式先期实现局部确认。确认方式可在下述中选择一种。
1) 技术部组织或报请上级组织召开新产品会,邀请公司外的有关和顾客参加会议,会对产品认可并形成《新产品报告》,即可视同已被确认。
2) 试产合格的产品需要经顾客实际使用一段时间以后才能完成确认工作的,由销售部门与顾客沟通后交顾客使用一段时间,顾客对使用情况表示满意可视为对设计开发的确认。
3) 全新产品也可送往国家授权的试验室进行型式试验并出具试验报告,即可视为对设计开发的确认。
上述确认形式提供的报告及相关资料是确认的证据。如果在确认中有某些不足,技术部门应及时进行分析。并采取相应的改进措施,确保设计开发的产品全面满足顾客的要求。
ISO13485认证内容
ISO13485认证标准是器械生产和质量管理的基本准则,适用于器械制剂生产的全过程生产中影响成品质量的关键工序。它可以加强器械管理,强化企业质量控制,保证病患者的人身安全;为用户提供质量稳定的产品能提高和改善企业的管理水平,增加企业的度;提高和保证产品的质量水平,使企业获取更大的经济效益;有利于消除贸易壁垒,取得进入国际市场的通行证;有利于增强产品的竞争力,提高产品的市场占有率。
2016版ISO13485认证标准的发布为推动我国器械生产质量管理的水平提供了一个重要的前提和机会。借鉴美国FDA的经验,依据美国和欧洲一些国家的作法,推动器械生产质量管理规范的工作。2016版ISO13485的推行有利于我国器械生产企业管理水平和产品实物质量上一个新的台阶,有利于确保器械的安全有效,有利于器械监督管理的深化,有利于器械质量认证事业的发展,有利于我国器械行业的健康快速发展。
下的ISO13485和ISO9001认证的行业发展
器械行业属于高技术行业,涉及到医药、机械、电子、塑料等多个行业,生产工艺相对复杂,进入门槛较高,是一个国家制造业和高科技水平的标志之一,在我国属于国家重点鼓励发展的产业。
中国器械产业由小到大,*发展,现已成为一个产品门类比较齐全、创新能力不断增强、市场需求十分旺盛的朝阳产业。虽然近年来,器械产业发展速度有一定减慢,主要原因是连续高增长后基数较大,但是产品出口的数量和科技含量也不断提升。
据前瞻产业研究院发布的《器械行业市场需求预测与投资战略规划分析报告》数据显示,“十二五”器械创新突破取得重大成效,在“十二五”国产化取得长足进步的基础上,“十三五”将进一步加强自主创新,坚持走的自主创新之路,实现器械领域弯道**车;坚持以需求为导向,加强提升能力,集中力量解决问题。前瞻产业研究院预测,未来五年中国器械的增长依然会**社会工业平均增长速度,但是增速会有回落。2022年器械行业收入将达到4659.83亿元。
中国器械行业发展趋势分析
1、中国器械行业朝集群化、相对垄断性发展
中国器械行业地域集中度较高,具体表现在绝大多数制造企业集中在江苏、广东、浙江、山东、上海和北京,其中前6个省市中有4个处于华东地区,剩下两个分别在华南和华北。
此外,器械产品需求的世界性和生产集中性,使器械产品成为世界贸易广泛的产品之一。由于器械产业高技术、高风险等特征及市场竞争激烈程度,使得器械制造业为少数大医药企业所垄断,使少数发达国家和部分发展中国家在**医药市场中占据着重要的位置,尤其自80年代以来世界器械企业并购重组浪潮愈演愈烈,跨国企业兼并收购进一步加大了市场集中度。
2、中国器械行业将向高科技、人性化发展
中国的器械产业将向更高科技、更人性化的方向发展,如今生物智能以及机器人智能发展有很大的突破。中国也将在未来的器械中加入高科技的因素,如机械传感器材、智能器械实验系统等等。另外,中国的器械产业将以家庭为单位生产出更适用于家庭自我监护、诊断及远程器械产品。
另一方面,中国的器械产业将开启微创器械的新时代,过去器械产品度不高,在疾病的同时可能会产生一些负作用,然而现在器械开始进入无创伤或微创伤的时代,一些微型化、智能化的器械将是未来的发展方向,中国还将大力发展移植和器械,如心脏移植、皮肤移植、血管移植等,以大程度地防御生命健康安全方面出现的隐患。
3、低端市场竞争激烈
在新医改的推动下,中国低端器械市场需求显现,为行业提供了新的发展契机。目前,中低端器械的增长率达30%,国内企业占据中低端器械市场75%以上的份额;同时国外企业也纷纷针对中低端市场开发设备。
早在几年前,外资企业就已开始涉足中国中低端的器械市场,现在随着中国新医改的推行,外资进**国中低端器械市场又开始大步行进。2008年新华与GE进行了合资,GE所看中的正是前者在基层领域的经验和渠道,其已推出相关系列设备,计划以优惠的价格销往农村机构。强生器械亦将农村、社区机构视为未来发展重点。
飞利浦苏州基地将以生产64排CT、1.5TMR以及X射线设备为主,将在未来5年内累计投资5400万美元,聚集了研发、制造、组装与采购等设施。此外,该基地的研发中心将为本地量身定制的影像系统。同时,飞利浦继沈阳和深圳之后建设苏州基地,也完善了其在地域上的战略布局。
德国西门子也召开了基层器械市场的媒体座谈会,表示要进**国中低端器械市场。西门子的优势产品线,如X光机、CT和超声机都将开发出适应基层服务的型号。未来西门子的业务将有40%立足于基础,60%面向中。外资加速进入中国低端器械市场,将加剧该细分市场的竞争。
ISO13485标准是一个立的标准,其、结构及某些的内容虽然与ISO9001标准相同,但由于ISO13485结合了器械行业的特点,重点**了法律法规要求、淡化了顾客满意、删减了ISO9001标准的一些重要要求,因此满足ISO13485标准的要求并不等于同时满足了ISO9001标准的要求。简单来说,两者主要区别如下:
1)适用范围不同;
2)根本核心思想不同;
3)ISO13485标准中关于删减的规定与ISO 9001不同;
4)与ISO9001标准相比较,ISO13485没有过程模式图;
5)与ISO9001标准相比较,ISO13485是对产品技术要求的补充;
6)与ISO9001标准相比较,ISO13485中对文件化程度的要求更高等等。
http://sqs888.cn.b2b168.com
欢迎来到上海赛学企业管理有限公司网站, 具体地址是上海市闵行区莘庄镇莘松路380号智慧园商务大厦211室,联系人是余韵。
主要经营上海赛学企业管理有限公司主要从事:管理体系认证、售后服务认证、苏州ISO20000认证、质量体系认证、苏州ISO认证、苏州质量管理体系认证。上海赛学企业管理有限公司致力于标准和管理咨询的研究及应用,曾为众多企业提供过管理服务。我们聘请上海交通大学、复旦大学、华东师范大学、上海二工业大学、浙江农林大学的教授来公司授课和指导,在管理理论新动向,培训及案例研讨等方面进行深入广泛的交流。免费咨询!
。
单位注册资金单位注册资金人民币 100 万元以下。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:管理体系认证,售后服务认证,苏州ISO20000认证,质量体系认证,苏州ISO认证,苏州质量管理体系认证等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们较大的收益、用户的信赖是我们较大的成果。